Antisekretorni lekovi se dele u dve grupe: Inhibitore protonske pumpe i blokatore H2 receptora.
Inhibitori protonske pumpe
Inhibitori protonske pumpe (IPP) su najpotentnija grupa antisekretornih lekova, do sada sintetizovana, koja se koristi kod oboljenja digestivnog trakta koja su povezana sa pojačanom sekrecijom HCL, kao i u drugim stanjima. Direktnim dejstvom na protonsku pumpu postiže se znatno veća inihibija lučenja kiseline, nego što je to kada se blokira samo jedna vrsta receptora (histamin, gastrin, acetilholin). Ovakvim mehanizmom dejstva priroda stimulusa koji dovodi do lučenja kiseline, ne igra više ulogu.
Prvi inhibitor protonske pumpe, omeprazol je u kliničkoj upotrebi od 1988. godine. Farmaceutska industrija je pratila povećanu potrošnju ove grupe, lekova tako da se u ovom trenutku u svetu primenjuje 5 inhibitora protonske pumpe: omeprazol, lansoprazol, pantoprazol, rabeprazol i esomeprazol. U fazi kliničkih studija je i tenatoprazol, a u fazi eksperimentalnih istraživanja je ilaprazol.
- omeprazol
- lansoprazol
- pantoprazol
- esomeprazol
IPP su grupa lekova koja smanjuje sekreciju HCl inhibicijom H+, K+-ATPase, tzv. protonska pumpa. Svi IPP su substituisani benzimidazoli.
Esomeprazol je S optički isomer omeprazola. Ovi lekovi predstavljaju prolekove koje HCl mora da aktivira da bi izazvali 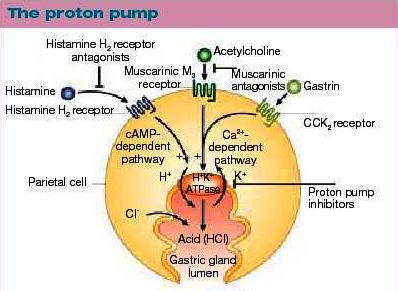 inhibiciju H+, K+-ATPase. Treba znati da su prolekovi HCl-labilna jedinjenja koja moraju da se zaštite od razgradnje u želucu tokom oralne primene, što uslovljava da su dostupni u formi kapsula koje se kasno oslobađaju u tankom crevu.
inhibiciju H+, K+-ATPase. Treba znati da su prolekovi HCl-labilna jedinjenja koja moraju da se zaštite od razgradnje u želucu tokom oralne primene, što uslovljava da su dostupni u formi kapsula koje se kasno oslobađaju u tankom crevu.
IPP su slabe baze, koje se dobro absorbuju nakon oralnog unošenja, a istovremeno uključivanje antacida ne utiče na njihovu bioraspoloživost.
Hrana može da uspori apsorpciju IPP, što ne utiče na površinu ispod krivulje koncentracije plazme kao ključnog faktora u efikasnosti ovih lekova.
Inhibitori protonske pumpe se metabolišu u jetri preko sistema enzima citohrom P450, posebno CYP2C19, inaktivni produkti metabolizma se ekskretuju mokraćom.
Izgleda da su genotipske razlike u CYP2C19 odgovorne za različitu kliničku efikasnot IPP-a.
Metabolizam IPP
Postoje izvesne razlike u jetrenom metabolizmu pojedinih IPP-a (metabolišu se sporije od drugih), što može da rezultira u većoj inhibiciji HCL-a. Nije potpuno jasno da li ovaj efekat utiče na bilo kakvu kliničku prednost pojedinih IPP-a u epitelizaciji duodenalnih i želudačnih ulkusa. Iako je plazmatski poluživot IPP kraći od 2 sata, trajanje inhibicije HCl je dugačko (>24 časa), kao rezultat kovalentnog vezivanja za enzim H+, K+-ATPase. IPP se predominantno vezuju za protonske pumpe koje aktivno sekretuju kiselinu, što znači da je efikasnost IPP u inhibiciji HCl ograničena, ako se oni primenjuju tokom posta, kada je samo oko 5% protonskih pumpi želuca sekretorno aktivno.
Sa obrokom 60-70% protonskih pumpi aktivno sekretuje kiselinu. Dakle, IPP su najefikasniji kada se ordiniraju pre obroka, 15-30 minuta. Kada se dozira jednom dnevno IPP treba ordinirati pre doručka. Inhibicija aktivne sekrecije acidne pumpe je ireverzibilna , ali je vremenski zavisna. Nakon prve doze IPP, koncentracija leka se smanjuje, bilo koja protonska pumpa iz citoplazme koja se umeće u sekretorne kanale sposobna je da luči kiselinu do druge doze IPP (18).
Pumpe koje su aktivirane inhibiraju drugom dozom IPP, koja ima kumulativni efekat na prethodno postojećim acidnim pumpama. To uslovaljava da se intragastrična kiselost brzo vraća posle samo jedne oralne doze IPP. IPP imaju produženu i visoko efikasnu inhibiciju bazalne i želudačne sekrecije izazvane hranom. Efekat IPP na intragastričnu kiselost zavisi od doza.
Lekovi iz grupe IPP utiču i na peptičku aktivnost jer smanjuju lučenje pepsina, smanjuju zapreminu sekrecije. Aktivacija pepsina je zavisna od pH, pa povećavajući intragastrični pH>4, IPP eliminišu peptičku aktivnost.
IPP koji se koriste u terapiji bolesti povezanih sa pojačanom sekrecijom HCl su veoma slični u sposobnosti da kontrolišu 24-časovni pH kada se primenjuju jednom dnevno, kontroli pH preko noći i stepeni izlečenja acido-peptičnih oboljenja, nakon terapije u trajanju od 4-8 nedelja, premda IPP poslednjih generacija imaju sporiji metabolički klirens i kontrola intragastričnog pH>4 u toku 24h duže traje.
Intragastrična kontrola pH u toku primene IPP zavisi od prisustva H.pylori infekcije . Intragastrična kontrola pH je bolja kada je infekcija odsutna. U literaturi je opisana i rezistencija na IPP. I pored dve doze IPP u toku dana, 35-50% bolesnika i dalje, u toku ispitivanog vremenskog perioda, ima intragastrični pH<4, koji se ne može kod nekih bolesnika poboljšati daljim povećanjem doze leka.
Noćni kiseli proboj (nocturrnal gastric acid breakthrough)
Poslednjih godina velika pažnja se posvećuje tzv. noćnom kiselom proboju (nocturrnal gastric acid breakthrough) koji opisuje da bolesnici i pored primene IPP nastavljaju da izlučuju kiselinu i smanjuju intragastrični pH ispod 4, najmanje 1h u toku noći. Kod davanja jedna doze IPP noćni kiseli proboj se ispoljava oko 23h, a kod davanja dve doze, ispoljava se 6-7h nakon večernje doze (izmedju 01h i 04h).
Noćni kiseli proboj se ispoljava nakon primene svih IPP, što je od posebnog značaja u terapiji gastroezofagealne refluksne bolesti ( gorušica, žgaravica) i komplikacija. Bolesnici koji imaju poremećaj motiliteta jednjaka i smanjenim pritiskom donjeg ezofagusnog sfinktera i neefikasnom perstaltikom, mogućnost za refluks u toku noćnog kiselog proboja je 8 puta veća, u odnosu na bolesnike kod kojih su motilitetni parametri jednjaka normalni. Kiseli noćni proboj ima implikacije na novije terapijske opcije koje podrazumevaju kombinaciju IPP i blokatora H2 receptora. Pri dugotrajnoj terapiji IPP, inhibicija lučenja HCl može da dovede do refleksnog povećanja nivoa gastrina. Tokom ispitivanja IPP kod zdravih dobrovoljaca, ovaj povratni mehanizam osigurava adekvatnu sekreciju kiseline.
U eksperimentalnih životinja, pacova, produženi nivo visokih vrednosti gastrina, dovodi do povišene proliferacija ECL ćelija. Hronična hipergastrinemija može da progredira do karcinoma želuca u pacova. U humanoj populaciji nikakve morfološke promene na želucu nisu zapažene, koje bi bile posledica hipergastrinemije tokom kraćeg ili dužeg vremena. Predpostavka je da će snažna inhibicija lučenja kiseline dovesti do anaciditeta, i kao rezultat toga nastanak povećanog broja bakterija u želucu sa lokalnim stvaranjem nitrozamina nije potvrđena.
Velika studija kontinuirane primene omeprazola (do 11.2 godine, prosečno 6.5 godine) u bolesnika sa umereno ozbiljnom 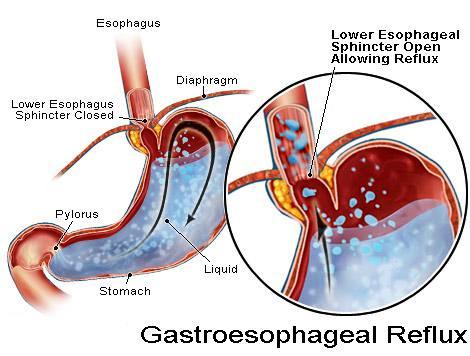 refluksnom bolešću u rezistentnih na terapiju blokatorima H2 receptora, pokazala je sigurnost i efikasnost kontinuirane terapije omeprazolom.
refluksnom bolešću u rezistentnih na terapiju blokatorima H2 receptora, pokazala je sigurnost i efikasnost kontinuirane terapije omeprazolom.
U periodu praćenja, rutinske biopsije sluzokože korpusa nisu otkrile postojanje displazije i karcinoma korpusnog dela želuca.
IPP su bolji od drugih medikamenata za olakšanje simptoma gorušice i regurgitacije, epitelizacije ulceracija, eradikacije H.pylori i održavanje remisije različitih endoskopskih bolesti.
Niska cena koštanja, generički IPP, mogućnost slobodne prodaje bez recepata (over the counter-OTC) od 2003 godine u SAD menjaju stare dogme o terapiji bolesti povezanih sa pojačanom sekrecijom HCl. IPP se ordiniraju kontinuirano i diskontinuirano.
Terapijski pristup
Kontinuirana terapija je svakodnevna, najčešće jednom ili dva puta dnevno u dozama od 20-40 mg u zavisnosti od medikamenta. Ova terapija je kontinuirana određeno vreme i nakon prestanka ili olakšanja simptoma bolesti. Nekontinuirana terapija podrazumeva nekoliko opcija: na zahtev, intermitentna i planirana non-daily terapija. Terapija na zahtev se ordinira samo kada se simptomi bolesti ispolje, a prekida se kada se oni olakšaju. Intermitentna terapija podrazumeva korišćenje lekova u prethodno određenim ciklusima terapija kod svake pojave simptoma, bez obzira da li su se simptomi olakšali. Planirana non-daily terapija uključuje alternativnu dnevnu ili nedeljnu terapiju gde se IPP uključuju bez obzira na prisustvo ili odsustvo simptoma u intervalima koji su duži od dnevne terapije.
Blokatori H2 receptora
Sedamdesetih godina prošlog veka James Black kreira antagonist H2 receptora (blokator H2 receptora) kada započinje nova era u terapiji bolesti povezanih sa pojačanom sekrecijom HCl. Petnaestak godina kasnije za svoju kreaciju dobija titulu sera i Nobelovu nagradu iz medicine. Nakon cimetidina, stvoreni su ranitidin, famotidin, nizatidin, roksatidin, a poslednjih godina i lafutidin.
Histamin
Histamin se nalazi u svim tkivima našeg organizma, a najviša koncentracija je zabeležena u plućima, koži i digestivnom traktu. U efektima histamina posreduju receptori koji se nalaze na površini ćelije. Poznata su različita histaminska receptora: H1, H2 i H3 receptori. Stimulacija H2 receptora na parijetalnoj ćeliji korpusa želuca dovodi do povećanog žlezdanog lučenja, posebno u mukusnoj membrani želuca. Antagonisti H2 receptora se utrkuju sa histaminom za H2 receptore parijetalne ćelije. Vezivanje blokatora H2 receptora ne aktivira parijetalnu ćeliju, već rezultira inhibicijom histamin zavisne produkcije želudačne kiseline. Lučenje kiseline uzrokovano gastrinom i acetilholinom se delimično inhibiše.
Terapijski pristup
Dnevna doza blokatora H2 receptora se primenjuje kao pojedinačna, uveče, pred spavanje ili podeljeno u dve pojedinačne doze (jutarnja i večernja). Blokatori H2 receptora su jedna od najpropisivanijih grupa lekova, ne samo u terapiji bolesti povezanih sa pojačanoms ekrecijom HCl, nego i u mnogim drugim stanjima kada pravu dijagnozu još uvek nemamo.
Konsenzus u Maastrichu 1997. godine je kao antisekretornu terapiju za eradikaciju H.pylori dozvoljavao izbor između blokatora H2 receptora, ili inhibitora protonske pumpe, dok poslednji Konsenzus iz 2000. godine isključuje blokatore H2 receptora iz antisekretorne kombinacije, uz mogućnost da se ordinira fiksna kombinacija ranitidina i bizmuta.
Savremeni koncepti lečenja
Savremeni koncepti lečenja stanja praćena hipersekrecijom HCl podrazumevaju ordiniranje IPP, a ne blokatora H2 receptora. Dakle, u takvim stanjima blokatori H2 receptora gube na značaju. Zapaženo je da produžena blokada H2 receptora i do nekoliko meseci nakon epitelizacije duodenalnog i želudačnog ulkusa smanjuje recidiv ulkusne bolesti. Blokatori H2 receptora su efikasni u smanjenju lučenja kiseline u bazalnim uslovima, ali su manje efikasni nakon uzimanja obroka. Tokom primene H2 antagonista, zapažena je pojava razvoja tolerancija, kao posledica ushodne regulacije broja gastrinskih i histaminskih receptora. Poslednjih godina blokatori H2 receptora ponovo dobijaju na značaju sa aktiviranim konceptom o noćnom kiselom proboju.
Objavljeni su podaci o privremenom prolaznom povećanju kisele želudačne sekrecije posle prestanka primene H2 blokatora. Mehanizam koji leži u osnovi ove acidne hipersekrecije nakon prestanka uzimanja leka nije sasvim jasan i ne može da se poveže sa hipergastrinemijom. Možda povećana količina H2 receptora i adenilat ciklaze parijetalnih ćelija može biti uzrok acidne hipersekrecije. Potpuna kontrola noćne kiselosti i kiselog noćnog proboja može da se postigne samo kombinacijom IPP dva puta dnevno u punoj dozi i blokatora H2 receptora u jednoj dozi pre spavanja.









Broj komentara: 0
Vaš komentar nam je veoma dragocen, molimo upišite ga ovde